3 апреля 2025 года в авторитетном журнале Scientific Reports (входит в группу Nature) была опубликована статья французских исследователей, в которой показано, что молекулярный водород подавляет рост раковых опухолей.
https://pubmed.ncbi.nlm.nih.gov/40181080/Контекст
Инулин — это пищевая добавка из класса пребиотиков, стимулирующая рост полезных бактерий кишечника. Ранее было показано, что регулярное потребление инулина может тормозить рост опухолей, в том числе меланомы.
Предполагалось, что эффект связан с короткоцепочечными жирными кислотами (SCFA), но новые данные показывают, что эффект связан с водородом (H₂).
Приводим перевод части статьи:
Потребление инулина и продукция молекулярного водорода (H₂) изучались как на животных моделях, так и в клинических испытаниях. Поскольку H₂ является одним из основных побочных продуктов ферментации инулина бактериями кишечной микрофлоры, мы выдвинули гипотезу, что именно H₂ может вызвать противоопухолевый эффект инулина. Кроме того, оба вида лечения (инулин и H₂-терапия) одинаково подавляли рост опухоли меланомы. Эти результаты подтверждают механизм, при котором водород, вырабатываемый кишечными бактериями из инулина, способствует наблюдаемым противораковым эффектам.
Чтобы проверить это, мы сравнили влияние добавок инулина с воздействием H₂-терапии (HT) на рост имплантированных опухолей меланомы и на иммунный ответ CD8⁺ T-клеток. Кроме того, оба типа лечения одинаково подавляли рост опухоли меланомы. Эти результаты подтверждают механизм, согласно которому H₂, вырабатываемый бактериями кишечника при ферментации инулина, участвует в наблюдаемых противоопухолевых эффектах.
Водород (H₂) исторически считался инертным газом без биологической активности у млекопитающих. Однако за последние два десятилетия было обнаружено, что вдыхание H₂ или приём H₂-насыщенной воды может вызывать различные биологические эффекты, включая антиоксидантные, противовоспалительные и цитопротекторные действия. Эти открытия вызвали интерес к H₂ как потенциальному терапевтическому агенту при заболеваниях, связанных с окислительным стрессом, воспалением и старением, включая рак.
В этом исследовании мы использовали как in vivo модели мышей с имплантированной меланомой, так и анализ иммунного ответа CD8⁺ T-клеток, чтобы сравнить эффекты инулина и H₂-терапии. Мы показали, что оба вмешательства активируют иммунный ответ и уменьшают рост опухоли, предполагая участие одного и того же сигнального пути. Это даёт основание рассматривать кишечный микробный метаболизм инулина как источник биологически активного H₂.
Мы начали с оценки способности инулина и H₂-терапии подавлять рост опухоли у мышей с подкожно имплантированной меланомой B16. Животные получали либо пероральные добавки инулина, либо подвергались лечению H₂, растворённым в воде. Оба подхода значительно снизили объём опухоли по сравнению с контрольной группой. Не наблюдалось существенной разницы между эффектами инулина и H₂, что указывает на возможную общую биологическую мишень или путь действия.
Обе терапии — инулин и H₂ — усиливали инфильтрацию CD8⁺ T-клеток в опухоль, а также увеличивали долю клеток, экспрессирующих маркеры активации. Эти результаты подтверждают гипотезу о том, что наблюдаемый противоопухолевый эффект связан с активацией адаптивного иммунного ответа, возможно, под влиянием H₂.
Мы измерили уровень водорода в выдыхаемом воздухе мышей, чтобы проверить, действительно ли инулин индуцирует выработку H₂ в организме. У мышей, получавших инулин, концентрация водорода в выдохе была значительно выше, чем у контрольной группы. Это подтвердило, что кишечная ферментация инулина является источником H₂ in vivo.
Затем мы исследовали, может ли эффект инулина быть заблокирован при устранении водорода. Для этого мы использовали ингибитор кишечной ферментации — антибиотик, уменьшающий активность микрофлоры, производящей H₂. У мышей, получавших инулин и антибиотик одновременно, противоопухолевый эффект инулина исчезал. Это свидетельствует о том, что водород, производимый микробиотой, необходим для реализации защитного действия инулина.
Мы также сравнили воздействие инулина с прямым введением H₂ в питьевую воду (т.н. H₂-терапия). Обе группы мышей показали схожее подавление роста меланомы и сходные изменения в иммунных клетках опухолевой ткани. Таким образом, H₂ сам по себе способен воспроизводить эффекты инулина, что ещё раз подчёркивает его ключевую роль в механизме действия.
Наконец, чтобы проверить общность эффекта, мы провели аналогичные эксперименты на другой линии опухоли — колоректальной карциноме CT26. Результаты подтвердили, что как инулин, так и H₂-терапия снижают рост опухоли и активируют противоопухолевый иммунный ответ. Это усиливает предположение, что H₂ может быть универсальным медиатором иммуномодулирующих и противораковых эффектов инулина.
Наши данные показывают, что H₂, образующийся при ферментации инулина кишечной микрофлорой, не просто побочный продукт, а активный участник иммунной и противоопухолевой модуляции. Этот результат перекликается с предыдущими исследованиями, в которых молекулярный водород проявлял противовоспалительные и антиоксидантные свойства, а также положительно влиял на различные патологии, включая нейродегенеративные заболевания, диабет и рак.
Результаты
1. Экспозиция к водороду после приёма инулина
Гаваж инулина вызывал транзиторное, но значительное повышение уровня выделяемого водорода у мышей: пик концентрации наступал спустя 2 часа после введения и сохранялся на повышенном уровне до 4 часов.
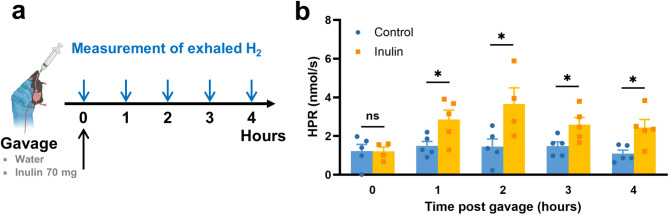
(a) Схема эксперимента: мышам линии C57BL/6 (n = 6 на группу) однократно вводили 70 мг инулина или воду через зонд (gavage) и измеряли выделение водорода с выдыхаемым воздухом через 0, 1, 2, 3 и 4 часа после введения. (b) Динамика скорости продукции водорода (Hydrogen Production Rate, HPR, в нмоль/с) у животных, получавших инулин (жёлтая группа) или воду (синяя группа). Данные представлены как среднее ± стандартная ошибка (SEM); каждая точка — результат отдельного измерения (всего 4–5 независимых серий экспериментов). *p < 0.05 по сравнению с контролем; ns — статистически незначимо (тест Манна–Уитни).
2. Иммунный ответ
Оба вмешательства — как инулин, так и H₂-терапия — вызывали схожее увеличение циркулирующих CD4⁺, CD8⁺ и γδ T-клеток. Повышалась также доля этих клеток, продуцирующих интерферон-γ (IFN-γ), ключевой цитокин в противоопухолевом иммунитете. Эти данные свидетельствуют о схожем иммунном профиле в ответ на оба вида воздействия.
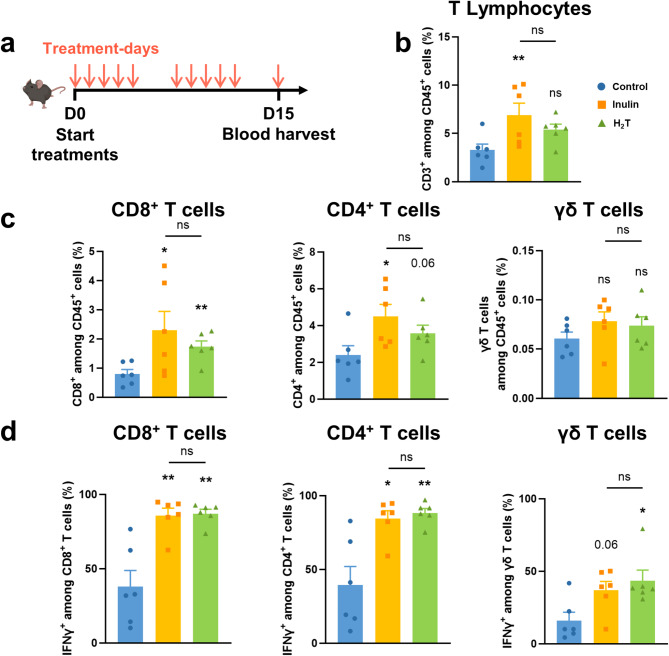
Инулин и водородная терапия вызывают схожий иммунностимулирующий эффект в крови.
(a) Схема эксперимента: мыши линии C57BL/6 (n = 6 в каждой группе) получали либо стандартную диету (контроль), либо 70 мг инулина перорально (группа инулина), либо подвергались ингаляции водорода в течение 2 часов (группа H₂T), 5 раз в неделю. Через 15 дней после начала лечения проводили анализ крови методом проточной цитометрии.
(b) Частота циркулирующих T-лимфоцитов (CD3⁺ среди CD45⁺ клеток).
(c) Частота циркулирующих CD8⁺, CD4⁺ и γδ TcR⁺ T-лимфоцитов среди всех T-клеток.
(d) Доля CD8⁺, CD4⁺ и γδ T-клеток, продуцирующих интерферон-γ (IFN-γ). Данные представлены как среднее ± стандартная ошибка среднего (SEM). Статистическая значимость по сравнению с контролем: *p < 0.05; **p < 0.01; ns — различия статистически незначимы (тест Манна–Уитни).
3. Рост опухоли
В обеих группах наблюдалось статистически значимое торможение роста опухоли по сравнению с контролем. Средний объём опухолей через 13 дней после имплантации составлял:
- 151,4 ± 48,8 мм³ в контрольной группе,
- 39,3 ± 11,9 мм³ в группе инулина,
- 56,4 ± 13,2 мм³ в группе H₂-терапии.
При этом различия между двумя последними группами были статистически незначимыми, что указывает на возможный общий механизм действия.
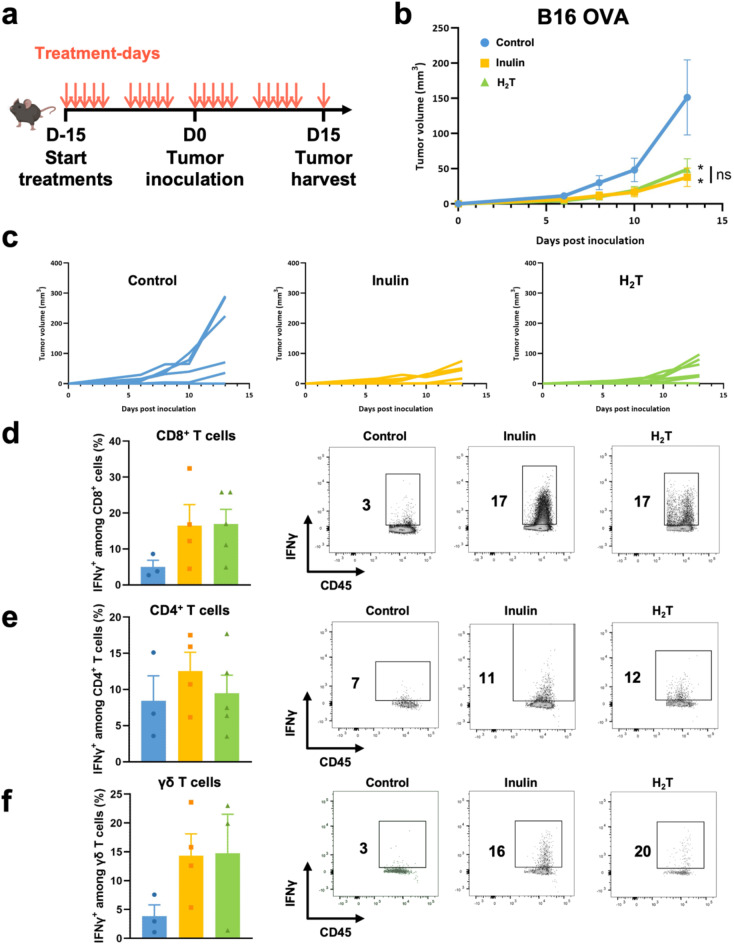
Инулин и водородная терапия демонстрируют схожий противоопухолевый эффект.
(a) Схема эксперимента: мыши линии C57BL/6 (n = 6 в каждой группе) получали либо стандартную диету (контроль), либо 70 мг инулина перорально (группа инулина), либо проходили ингаляционную терапию водородом по 2 часа в день (группа H₂T), 5 раз в неделю. Через 15 дней всем животным подкожно вводили 2 × 10⁵ клеток меланомы B16 OVA в правый бок.
(b–c) Динамика роста опухоли представлена как средние значения ± стандартная ошибка среднего (SEM) (b), а также индивидуальные кривые роста (c).
(d–f) Частота опухолевой инфильтрации IFN-γ-продуцирующими клетками: CD8⁺ (d), CD4⁺ (e) и γδ TcR⁺ T-лимфоцитами (f), определённая методом проточной цитометрии. Данные приведены как среднее ± SEM (n = 3–6). *p < 0.05 по сравнению с контролем; статистический анализ: двухфакторный ANOVA и тест Манна–Уитни.
Интерпретация
Результаты свидетельствуют в пользу гипотезы о том, что молекулярный водород способен активировать системный противоопухолевый иммунитет. Это особенно важно в свете того, что водород ранее рассматривался преимущественно как антиоксидант и противовоспалительное средство, но не как стимулятор иммунного ответа в онкологии.
Ограничения и перспективы
Авторы подчёркивают, что их работа имеет ряд методологических ограничений. В частности:
- Отсутствие возможности специфической блокировки H₂: В настоящее время не существует способа избирательно подавить водородообразование кишечной микрофлорой без воздействия на другие метаболиты, также потенциально участвующие в эффекте инулина (например, короткоцепочечные жирные кислоты). Поэтому прямое доказательство роли H₂ как единственного медиатора остаётся невозможным.
- Малый размер опухолей и вариабельность ответов: Высокая эффективность терапии привела к формированию очень маленьких опухолей у части животных, что затруднило анализ инфильтрации иммунных клеток и ограничило статистическую мощность исследований.
- Неполный охват иммунных популяций: В анализ не были включены такие клетки, как T-регуляторы, NKT-клетки и double-negative T-клетки, которые могут вносить вклад в наблюдаемые эффекты.
Тем не менее, несмотря на эти ограничения, полученные данные открывают перспективу нового подхода к онкологической терапии: непищевое введение водорода как замену или дополнение к пребиотикам. Это особенно актуально для пациентов с воспалительными заболеваниями кишечника или опухолями толстой кишки, у которых приём инулина может вызывать ухудшение состояния.
Клинико-практические выводы
Инулин — доступный и безопасный пребиотик с хорошо изученным профилем переносимости. Однако его применение может быть ограничено при заболеваниях ЖКТ. В то же время, молекулярный водород демонстрирует широкий спектр потенциально терапевтических свойств, включая:
- стимуляцию Т-клеточного звена иммунитета,
- восстановление функции истощённых CD8⁺ Т-клеток у онкологических пациентов,
- синергизм с иммунотерапией (по предварительным данным).
Применение водорода возможно как в форме ингаляций, так и в виде водородно-насыщенной воды. Также обсуждаются возможности локального применения, например, в виде кремов при кожных опухолях.
Заключение
Исследование, опубликованное в Scientific Reports (Nature) впервые ставит молекулярный водород в центр внимания как возможного звена между рационом, микробиотой и иммунной защитой от рака. Эти результаты требуют дальнейшего подтверждения, но уже сегодня открывают направление для разработки персонализированных и неинвазивных онкотерапий, основанных на применении молекулярного водорода.


